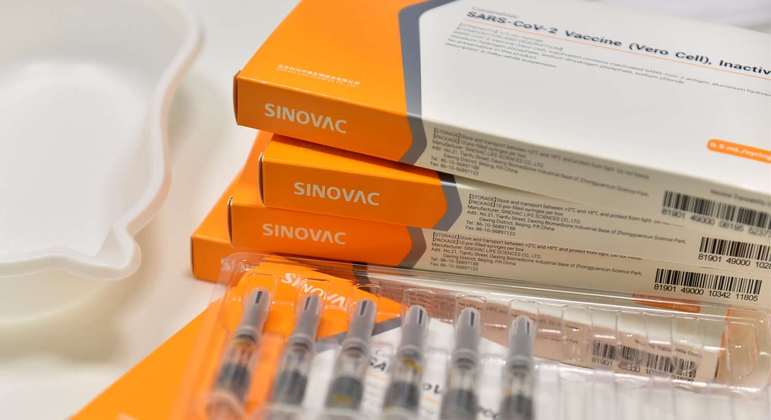
A Anvisa (Agência Nacional de Vigilância Sanitária) determinou neste sábado (4) a interdição cautelar de lotes da vacina CoronaVac, proibindo sua distribuição e uso no país. A suspensão se refere a 21 milhões de doses que foram envasadas em fábrica não inspecionada pela agência, na China.
A agência informa que foi comunicada pelo Instituto Butantan, em São Paulo, que produz o imunizante no Brasil, sendo também responsável pela importação dos lotes vindos da China, na na sexta-feira (3), de que o fabricante Sinovac havia enviado ao Brasil 25 lotes com 12.113.934 doses. Segundo a Anvisa, as vacinas que compõem esses lotes foram envasadas em local não inspecionado pela agência e, portanto, não têm aprovação para uso emergencial no Brasil.
A Anvisa ainda informa que, de acordo com o Butantan, somam-se a essas doses mais 17 lotes, com 9 milhões de doses, que também foram envasadas no mesmo local e estão em tramitação de envio e liberação ao Brasil.
A agência publicou neste sábado (4) na edição extra do Diário Oficial que adota interdição cautelar devido à “comprovação de realização da etapa de fabricação em local não aprovado pela Anvisa e em desacordo com o uso emergencial”.
A medida cautelar, que tem o prazo de 90 dias, é “um ato de precaução, que visa proteger a saúde da população, sendo adotada em caso de risco iminente à saúde, sem a prévia manifestação do interessado”, segundo a agência.
“Durante esse período, a Anvisa trabalhará na avaliação das condições de boas práticas de fabricação da planta fabril não aprovada, no potencial impacto dessa alteração de local nos requisitos de qualidade, segurança e eficácia, e do eventual impacto para as pessoas que foram vacinadas com esse lote. Além disso, serão feitas tratativas junto ao Instituto Butantan para regularização desse novo local na cadeia fabril da vacina junto à Anvisa”, finaliza.
O Instituto Butantan disse, em comunicado à imprensa, que “a medida da Anvisa não deve causar alarmismo”, e que “foi o próprio Instituto que, por compromisso com a transparência e por extrema precaução, comunicou o fato à agência, após atestar a qualidade das doses recebidas. Isso garante que os imunizantes são seguros para a população”.
Veja a íntegra da nota:
O Butantan esclarece que a medida da Anvisa não deve causar alarmismo. Foi o próprio Instituto que, por compromisso com a transparência e por extrema precaução, comunicou o fato à agência, após atestar a qualidade das doses recebidas. Isso garante que os imunizantes são seguros para a população.
O Instituto Butantan encaminhou à Anvisa há 15 dias toda a documentação necessária para a certificação do processo de produção em que foram feitas essas doses. Por isso, tem convicção que ela será concedida em breve. Caso necessário, pode complementar a solicitação com mais dados, inclusive da Sinovac, caso a agência julgue necessário.
A vacina do Butantan é o imunizante mais seguro à disposição do Programa Nacional de Imunizações (PNI), por causa da sua plataforma de vírus inativado.
Todos os lotes liberados pelo instituto estão de posse do Ministério da Saúde, como firmado em contrato. Reafirmamos, no entanto, que todas as doses que saíram da unidade fabril estão atestadas pelo rigoroso controle de qualidade do Butantan.
Informa, ainda, que 6 milhões de doses da vacina do Butantan, que fazem parte de um lote de 12 milhões de imunizantes formuladas no complexo fabril da zona oeste de SP, aguardavam liberação da Anvisa. Na última quinta-feira (2), o órgão regulatório liberou e as mesmas foram expedidas na sexta-feira (3).
Esse pedido de liberação ao órgão regulatório aconteceu por uma mudança em uma das etapas do processo de formulação da vacina, que pode ocorrer no decorrer da fabricação. A fábrica onde é feita a formulação e o envase da CoronaVac são todas certificadas pela Anvisa, desde o final de 2020.
O Butantan convida a cúpula da Anvisa para voltar a conhecer as instalações das fábricas da Sinovac, na China, e reforça o seu compromisso com a saúde pública, que é comprovado ao longo de seus 120 anos de história. As informações são do R7.